
O Darmstádio é um elemento químico com o símbolo Ds e número atómico 110. É colocado como o mais pesado membro do grupo 10, mas nenhum isótopo conhecido é suficientemente estável para permitir experiências químicas para confirmar a sua colocação no grupo como o homólogo mais pesado da platina. Este elemento sintético é um dos assim chamados átomos super-pesados e foi sintetizado pela primeira vez em 1994, em uma instalação perto da cidade de Darmstadt , Alemanha, a partir da qual tem o seu nome. O isótopo de vida mais longa e mais pesado é conhecido Ds-281a com uma meia-vida de ~ 10s Embora uma possível isômero nuclear, Ds-281b tem uma não confirmado meia-vida de cerca de 4 minutos.
História[]
Descoberta oficial[]
O Darmstádio foi criada pela primeira vez em 09 de novembro de 1994, noGesellschaft für Schwerionenforschung (GSI) em Darmstadt , Alemanha , por Peter Armbruster e Gottfried Münzenberg , sob a direção do professor Sigurd Hofmann. Quatro átomosdo elemento foram detectados em uma reação de fusão nuclearcausada por bombardeamento de um alvo de chumbo -208 com íons de níquel-62:
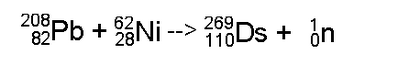
Na mesma série de experimentos, a mesma equipe também realizou a reação utilizando íons mais pesados Ni-64. Em duas etapas, 9 átomos de Ds-271 foram convincentemente detectados por correlação com as propriedades de decaimento para conhecidos isótopos-filhos:

Nomeação[]
Antes de ser nomeado em definitivo, o darmstádio recebeu o nome sistemático Ununílio. Uma vez reconhecidos como descobridores, a equipe da GSI considerou os nomes darmstadtium (Ds) e wixhausium (Wi) para o elemento 110. Eles decidiram sobre os primeiro e nomeado o elemento em homenagem à cidade perto do lugar de sua descoberta, Darmstadt, e não o subúrbio Wixhausen em si. O novo nome foi oficialmente recomendado pela IUPAC em 16 de agosto de 2003. O nome foi aprovado pela IUPAP em 4 de novembro de 2011.
Propriedades Químicas Previstas[]
Estrutura eletrônica do átomo de Ds.
Estados de Oxidação[]
Darmstádio é esperado para ser o oitavo membro da série 6d de metais de transição e do mais pesado membro do grupo 10 da Tabela Periódica, abaixo de níquel, paládio e platina . O estado de oxidação mais elevado confirmado de +6 é mostrado pela platina, enquanto que o estado +4 é estável para todos os elementos do grupo, exceto o níquel, em que é raro e muito oxidante. Estes elementos também possuem um estado de oxidação estável +2. Darmstádio é, portanto, previsto para mostrar estados de oxidação +6, +4 e +2.
Química[]
Há uma tendência observada de os estados de oxidação elevados deverão tornar-se mais estáveis à medida em que se desce pelo grupo, de modo que o Ds é esperado para formar um hexafluoreto estável, DsF6, além de DsF5 e DsF4. Um hexafluoreto também é observado para a platina (PtF6), mas ele é um composto pouco estável e extremamente oxidante, capaz de oxidar até mesmo o gás nobre xenônio. Reações com os demais halogênios deve resultar na formação dos tetra-haletos e DsCl4, DsBr4, e DsI4.
Como os outros elementos do grupo 10, espera-se que o Ds apresente uma dureza notável e propriedades catalíticas, além de uma reatividade química relativamente baixa, como ocorre com os membros mais pesados do grupo.
Fonte[]
- Artigo elaborado a partir da tradução e adaptação deste artigo da Wikipédia em inglês.